내용요약
중대성·시급성 따라 ‘1개월’ 또는 ‘3개월’ 차등 적용

[한스경제=홍성익 보건복지전문기자] 앞으로 의약품 허가사항이 변경될 경우 첨부문서(라벨) 교체에 필요한 유예기간을 현행 ‘1개월’에서 ‘최대 3개월’까지로 연장된다.
27일 식품의약품안전처(이하 식약처)에 따르면 그간 일괄적으로 적용해왔던 허가사항 변경 유예기간을 중대성과 시급성을 중점으로 ‘1개월’과 ‘3개월’로 차등 적용된다.
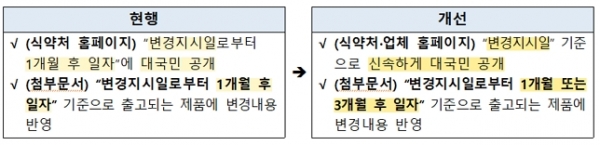
기존 재심사, 안전성 정보처리, 안전성·유효성 심사 결과 등에 따라 허가사항을 변경 지시한 경우 제약사는 정보 전달을 위해 1개월 내 첨부문서를 바꿔야했다.
이에 따라 안전성을 이유로 효능·효과, 용법·용량 제한, 사용상의 주의사항 중 ‘경고’ 또는 ‘금기’ 변경, 그밖에 중대성·시급성이 요구되는 정보의 변경에는 유예기간 1개월을 적용한다.
그 외 정보는 모두 유예기간이 3개월이다.
이와 함께 변경지시일로부터 1개월 후 변경된 사항을 식약처 홈페이지에 공개하던 것을 변경지시일 기준으로 가능한 한 신속하게 업체 홈페이지에도 게재할 계획이다.
식약처 융복합혁신제품지원단 허가총괄팀 오정원 과장은 “코로나19 확산으로 전 세계가 어려움을 겪고 있는 상황에서 업계의 애로사항을 해소하고 부담을 완화할 수 있는 정책 방향을 모색해서 개선하겠다”고 말했다.
홍성익 기자 hongsi@sporbiz.co.kr
관련기사
홍성익 기자
hongsi@sporbiz.co.kr


