
[한스경제=홍성익 보건복지전문기자] 식품의약품안전처(이하 식약처)가 인공지능(AI) 기반의 의료기기 적용 범위를 11개 품목에서 153개 품목으로 확대하는 등 ‘AI 기반 의료기기’ 허가심사 절차상의 규제를 대폭 개선했다.
‘AI 기반 의료기기’는 AI로 의료데이터를 분석해 질병의 진단 또는 예측 등을 목적으로 하는 의료기기를 말하며, AI 의료기기의 경우 후향적 임상시험으로 유효성 검증, 기계학습을 통한 허가변경 면제 등 허가 심사를 간소화할 수 있다.
30일 식약처에 따르면 이번 규제개선은 ‘신산업 현장애로 규제혁신 과제’의 일환으로 의료기기 기업들이 건의한 규제애로 사항을 해소하고, 의료기기의 신속 제품화를 지원하기 위해 추진했다.
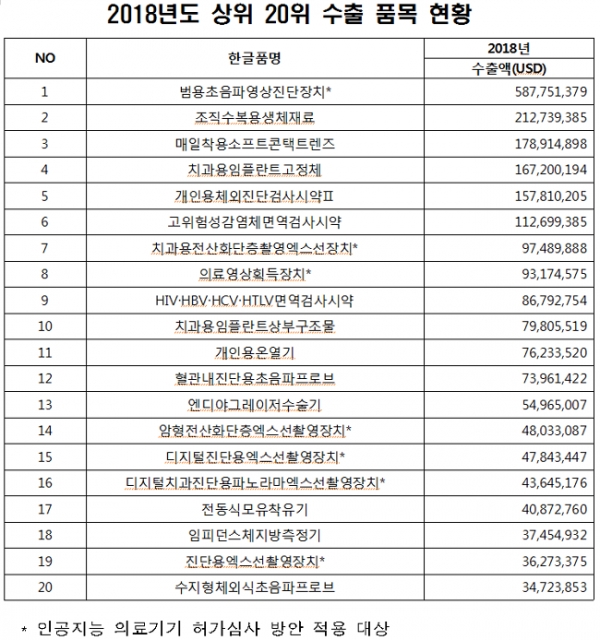
우선, 허가심사 가이드라인 2건(△‘빅데이터 및 인공지능 기술이 적용된 의료기기 허가심사 가이드라인’ △‘인공지능 기반 의료기기의 임상 유효성 평가 가이드라인’)을 개정해 AI 기반 의료기기 적용대상을 11개 품목에서 범용초음파영상진단장치, X-ray 등 153개 품목으로 확대했다.
이번 확대적용으로 혜택을 받는 범용초음파영상진단장치 등 7개 품목은 지난해 수출 상위 20위 내에 품목들로, 제품개발 시간 단축 등으로 국내 의료기기 산업의 경쟁력 확보에 도움이 될 것으로 전망된다.
이와 함께 식약처는 주요 4개 질환(△폐암·폐결절 △유방암 △허혈성 뇌졸중(뇌경색) △관상동맥협착)을 사례로 AI 의료기기의 임상시험계획 설계에 필요한 정보를 제공하고 제품개발 단계별 ‘자주 묻는 질의에 대한 응답(FAQ)’을 제공한다.
4개 질환 가이드라인의 주요내용은 △‘후향적 임상연구’ 방법 설계 사례 △질환별 피험자 선정/제외 기준 △유효성 평가변수 등이다. ‘후향적 임상시험’은 피험자 모집 대신 이전의 진료 또는 임상시험을 통해 획득된 피험자의 진료기록, 의료영상 등 의료 데이터를 이용해 의료기기의 안전성·유효성 검증을 실시하는 임상시험을 말한다.
이정림 식약처 첨단의료기기과장은 “신산업 의료기기 산업의 혁신성과 안전성을 제고하고, AI 의료기기에 대한 규제가 합리적으로 적용될 수 있도록 지속적으로 개선해 나가겠다”고 밝혔다.
홍성익 기자 hongsi@sporbiz.co.kr


