‘코로나19’ 백신 조기개발 지원 가이드라인 마련

[한스경제=홍성익 보건복지전문기자] 식품의약품안전처(이하 식약처)가 코로나19 백신의 임상시험 조기 진입을 돕고 제품화를 지원하기 위해 가이드라인을 마련하고, ‘K-백신 신속심사추진반’을 통해 11개 업체를 지원하고 있다.
16일 식약처에 따르면 ‘K-백신 신속심사추진반’은 코로나19 백신을 개발하는 업체에 맞춤형 상담을 해주고, 신속한 임상 진입을 지원하는 조직이다. 백신 심사를 총괄하는 전담심사팀, 내·외부 업무협력 전담 상황지원팀, 학계·병원 등의 외부전문가자문단으로 구성돼있다.
K-백신 신속심사추진반은 현재 11개 업체에 맞춤형 상담을 제공한다. 이중 2곳은 최근 임상 승인을 받은 미국 기업 이노비오와 국내 바이오 기업 제넥신이다. 나머지 9곳은 코로나19 비임상 개발 단계를 진행 중이다.
이와 함께 식약처는 코로나19 백신의 조기개발을 지원하기 위해 가이드라인을 마련했다. 주요 내용은 △임상시험용의약품의 품질자료 요건 △독성시험 등 비임상시험 고려사항 △최초 임상시험 시 고려사항 △안전성·유효성·면역원성 평가항목 설정 시 고려사항 △세계보건기구(WHO) 코로나19 백신 지침 등이다.
최영주 식약처 바이오심사조정과장은 “향후 국내에서 코로나19 백신이 조속한 시일 내에 개발될 수 있도록 새로운 과학적 정보, 국내·외 임상 정보 등을 제공할 계획”이라고 밝혔다.
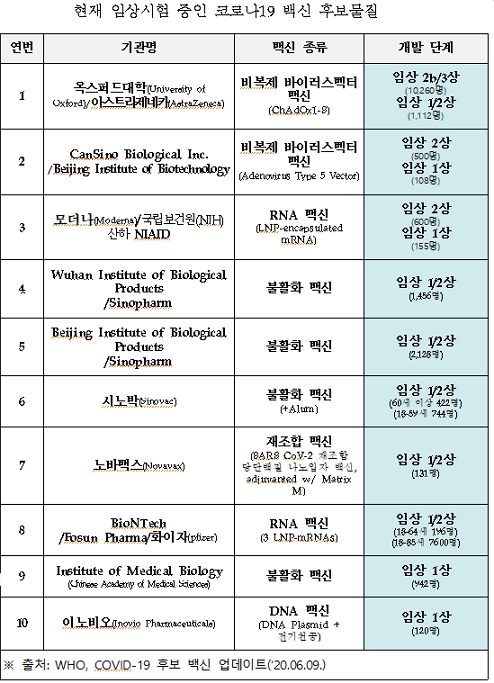
한편 코로나19 예방백신 개발은 전 세계적으로 10건이 인체에 투여하는 ‘임상시험’ 단계에 진입한 것으로 나타났다.
세계보건기구(WHO)에 따르면 옥스퍼드대학과 아스트라제네카의 비복제 바이러스벡터 백신 연구가 임상 2b/3상으로 가장 앞서 있다.
미국 바이오벤처 모더나와 국립보건원(NIH) 산하 미국 국립알레르기·전염병연구소(NIAID)의 연구는 임상 2상중이다.
재미 한국인 조셉 김 대표가 세운 미국 이노비오의 DNA 백신은 1상중이다.
홍성익 기자 hongsi@sporbiz.co.kr


